Addition électrophile en chimie organique
Les réactions d'attachement sont caractérisées par la formation deun composé chimique provenant de deux ou plusieurs des matières de départ. Considérons le mécanisme d'addition électrophile est commode pour l'exemple des alcènes - hydrocarbures acycliques insaturés avec une double liaison. En dehors de ceux-ci, d'autres hydrocarbures à liaisons multiples, y compris cycliques, entrent dans de telles transformations.
Les étapes de l'interaction des molécules initiales
La liaison électrophile a lieu dans plusieursétapes. L'électrophile, qui a une charge positive, agit comme un accepteur d'électrons, et la double liaison de la molécule d'alcène joue le rôle d'un donneur d'électrons. Les deux composés forment d'abord un complexe p instable. Puis commence la transformation du complexe π en complexe ϭ. La formation de carbocation à ce stade et sa stabilité déterminent la vitesse d'interaction dans son ensemble. Après cela, le carbocation interagit rapidement avec un nucléophile partiellement chargé négativement, et le produit final de la transformation est formé.

L'effet des substituants sur la vitesse de réaction
Délocalisation de la charge (ϭ +) dans le carbocationde la structure de la molécule d'origine. L'effet inductif positif que présente le groupe alkyle conduit à une charge plus faible de l'atome de carbone voisin. En conséquence, dans la molécule avec un substituant donneur d'électrons, la stabilité relative du cation, la densité électronique de la liaison π et la réactivité de la molécule dans son ensemble augmentent. L'effet des accepteurs d'électrons sur la réactivité sera opposé.
Le mécanisme d'addition d'halogène
Analysons plus en détail le mécanisme de la réaction d'addition électrophile par l'exemple de l'interaction de l'alcène et de l'halogène.
- La molécule d'halogène s'approche d'une double liaisonentre les atomes de carbone et est polarisé. En raison d'une charge partiellement positive à une extrémité de la molécule, l'halogène attire les électrons de liaison π. C'est ainsi que le complexe π instable est formé.
- Dans l'étape suivante, la particule électrophile se combine avec deux atomes de carbone pour former un cycle. Un ion "onium" cyclique apparaît.
- La particule d'halogène chargée restante(un nucléophile chargé positivement) interagit avec un ion onium et est connecté du côté opposé de la particule d'halogène précédente. Le produit final, le trans-1,2-dihalogénalcane, apparaît. De même, l'addition d'halogène au cycloalcène.
Le mécanisme d'addition d'acides halohydriques

Réactions d'addition électrophilesLes halogénures d'hydrogène et l'acide sulfurique procèdent différemment. Dans un milieu acide, le réactif se dissocie en un cation et un anion. Un ion chargé positivement (électrophile) attaque la liaison π, se combine avec l'un des atomes de carbone. Un carbocation se forme dans lequel l'atome de carbone voisin est chargé positivement. En outre, le carbocation réagit avec l'anion pour former le produit de réaction final.
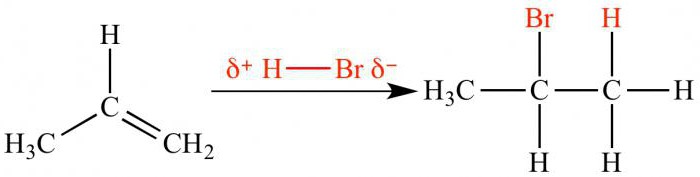
La direction de la réaction entre les réactifs asymétriques et la règle de Markovnikov

Fixation électrophile entre deuxmolécules asymétriques se produit de manière régiosélective. Cela signifie que les deux isomères possibles est de préférence formée d'un seul. Régiosélectivité décrit règle Markovnikov, selon lequel l'hydrogène est attaché à un atome de carbone relié à un grand nombre d'autres atomes d'hydrogène (plus hydrogéné).
Pour comprendre l'essence de cette règle, nous devons nous rappelerque la vitesse de réaction dépend de la stabilité du carbocation intermédiaire. L'influence des substituants donneur et accepteur d'électrons a été discutée ci-dessus. Ainsi, l'addition électrophile d'acide bromhydrique au propène aboutira à la formation de 2-bromopropane. Un cation intermédiaire avec une charge positive sur un atome de carbone central est plus stable qu'un carbocation avec une charge positive à l'atome extrême. En conséquence, l'atome de brome interagit avec le second atome de carbone.
Effet du substituant électro-attracteur sur le cours de l'interaction
Si la molécule source contientun substituant électro-attracteur ayant un effet inductif et / ou mésomère négatif, la fixation électrophile va à l'encontre de la règle décrite ci-dessus. Des exemples de tels substituants sont CF3, COOH, CN. Dans ce cas, la grande distance de la charge positive du groupe électro-attracteur rend le carbocation primaire plus stable. En conséquence, l'hydrogène se combine avec un atome de carbone moins hydrogéné.
Version universelle des règles ressemblera à ceci: l'interaction d'un alcène asymétrique et un produit de réaction de réactifs asymétriques par voie de formation du carbocation le plus stable.







