Les halogènes sont ... Les composés halogénés
Ici, le lecteur trouvera des informations sur les halogènes,éléments chimiques du tableau périodique de DI Mendeleyev. Le contenu de l'article vous permettra de vous familiariser avec leurs propriétés chimiques et physiques, de trouver dans la nature, les méthodes d'application, etc.
Informations générales
Les halogènes sont tous des éléments de la table chimique de DI Mendeleyev, située dans le dix-septième groupe. Par une méthode de classification plus rigoureuse, ce sont tous des éléments du septième groupe, le sous-groupe principal.
Les halogènes sont des éléments qui peuvent rejoindreréactions avec pratiquement toutes les substances d'un type simple, à l'exception d'un certain nombre de non-métaux. Tous sont des oxydants énergétiques, par conséquent, dans des conditions naturelles, en général, ils sont mélangés avec d'autres substances. L'indice d'activité chimique des halogènes diminue avec l'augmentation de leur numérotation.
Les halogènes sont les éléments suivants: le fluor, le chlore, le brome, l'iode, l'astat et les tanins artificiellement créés.
Comme mentionné précédemment, tous les halogènes sontoxydants avec des propriétés prononcées, en outre tous sont des non-métaux. Le niveau d'énergie externe a sept électrons. L'interaction avec les métaux conduit à la formation de liaisons ioniques et de sels. Presque tous les halogènes, à l'exception du fluor, peuvent se manifester en tant qu'agent réducteur, atteignant un degré d'oxydation supérieur à +7, mais pour cela, il est nécessaire qu'ils interagissent avec des éléments ayant un plus grand degré d'électronégativité.
Caractéristiques de l'étymologie

En 1841, le chimiste suédois J. Berzelius a proposé la mise en place de l'halogène à long terme, en se référant à leur connaissance à l'époque F, Br, I. Cependant, jusqu'à l'introduction du terme par rapport à l'ensemble du groupe d'éléments, en 1811, le scientifique allemand I. Shveygger le même mot appelé chlore, le terme il a traduit du grec comme « solerod ».
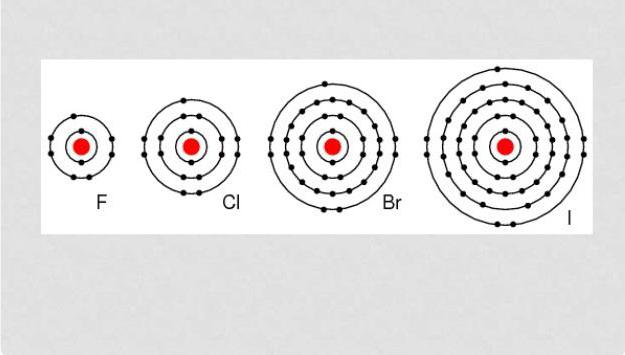
Structure atomique et pouvoirs oxydants

La configuration des électrons de la couche atomique externe des halogènes est la suivante: astat - 6s26p5, iode - 5s25p5, le brome 4s24p5, chlore - 3s23p5, fluor 2s22p5.
Les halogènes sont des éléments qui ont sur l'électroniquecoquille du type externe de sept électrons, ce qui leur permet "sans trop d'efforts" d'attacher un électron, ce qui n'est pas suffisant pour compléter la coquille. Typiquement, l'état d'oxydation est exprimé par -1. Cl, Br, I et At réagissant avec des éléments ayant un degré supérieur, commencent à montrer un degré oxydatif positif: +1, +3, +5, +7. Le fluorure a un degré d'oxydation constant -1.
Diffusion
Compte tenu de son haut degré de réactionLa capacité des halogènes est généralement sous la forme de composés. Le niveau de propagation dans la croûte terrestre diminue en fonction de l'augmentation du rayon atomique de F à I. L'astat dans la croûte terrestre est mesurée en grammes et Tennessina est créée artificiellement.
Les halogènes sont trouvés dans la nature le plus souventcomposés d'halogénures, et l'iode peut également prendre la forme d'iodate de potassium ou de sodium. En raison de leur solubilité dans l'eau, ils sont présents dans les eaux océaniques et les saumures d'origine naturelle. F est un insoluble représentant des halogènes et se trouve le plus souvent dans les roches sédimentaires, et sa principale source est le fluorure de calcium.
Caractéristiques qualitatives physiques
Les halogènes entre eux peuvent être très différents, et ils ont les propriétés physiques suivantes:
- Le fluor (F2) est un gaz de couleur jaune pâle, a une odeur forte et irritante, et ne subit pas non plus de compression dans des conditions de température normales. Le point de fusion est de -220 ° C et le point d'ébullition de -188 ° C.
- Chlore (Cl2) est un gaz qui ne contracte pas avecla température habituelle, même exposée à la pression, a une odeur suffocante et piquante et une couleur jaune verdâtre. La fusion commence à -101 ° C et bout à -34 ° C.
- Brome (Br2) Est un liquide volatil et lourd avec une couleur marron-brunâtre et une forte odeur fétide. Il fond à -7 ° C et bout à 58 ° C.
- Iode (I2) - cette substance solide a une couleur gris foncé, et il a un lustre métallique, l'odeur est assez forte. Le processus de fusion commence à 113,5 ° C et bout à 184,885 ° C.
- Un halogène rare est un astatine (At2), qui est un solide et a une couleur noire et bleue avec un lustre métallique. Le point de fusion correspond à une marque de 244 ° C, et l'ébullition commence après avoir atteint 309 ° C.

La nature chimique des halogènes
Les halogènes sont des éléments à très hauteactivité oxydante, qui est affaiblie dans la direction de F à At. Le fluor, étant le représentant le plus actif des halogènes, peut réagir avec toutes sortes de métaux, sans exclure aucun connu. La plupart des représentants des métaux, pénétrant dans l'atmosphère du fluor, subissent une auto-inflammation, tout en libérant de la chaleur en grande quantité.
Sans exposition au fluor à la chaleur, il peutréagir avec un grand nombre de non-métaux, par exemple H2, C, P, S, Si. Le type de réactions dans ce cas est exothermique et peut être accompagné d'une explosion. Lorsqu'il est chauffé, F force l'oxydation des halogènes restants, et lorsqu'il est soumis à une irradiation, cet élément est capable de réagir avec des gaz lourds de nature inerte.
En interagissant avec des substances de type complexe, le fluor provoque des réactions très énergiques, par exemple, en oxydant l'eau, il peut provoquer une explosion.

Le chlore peut également être réactif, en particulier dansétat libre. Le niveau de son activité est inférieur à celui du fluor, mais il est capable de réagir avec presque toutes les substances simples, mais l'azote, l'oxygène et les gaz rares ne réagissent pas avec lui. En interagissant avec l'hydrogène, avec un chauffage ou un bon éclairage, le chlore crée une réaction violente accompagnée d'une explosion.
Dans les réactions d'addition et de substitution, Cl peutréagir avec un grand nombre de substances de type complexe. Est capable de déplacer Br et I à la suite du chauffage des composés créés par eux avec un métal ou de l'hydrogène, et peut également réagir avec des substances alcalines.
Le brome est chimiquement moins actif que le chlore ou le fluor,mais se montre encore très brillamment. Ceci est dû au fait que, plus souvent, le brome Br est utilisé comme liquide, car dans cet état, le degré initial de concentration dans d'autres conditions identiques est plus élevé que celui de Cl. Largement utilisé en chimie, en particulier organique. Peut être dissous dans H2O et réagissez avec lui en partie.
L'élément halogène iodé forme une substance simple I2 et est capable de réagir avec H2O, se dissout dans les solutions d'iodure, formantCe sont les anions complexes. De la majorité des halogènes, je diffère en ce qu'il ne réagit pas avec la plupart des agents non métalliques et réagit lentement avec les métaux, alors qu'il doit être chauffé. Avec l'hydrogène réagit, ne subissant un fort chauffage, et la réaction est endothermique.
Un atome d'halogène rare (At) montre moins de réactivité que l'iode, mais peut réagir avec les métaux. À la suite de la dissociation, des anions et des cations apparaissent.
Applications
Les composés d'halogènes sont largement utilisés par l'homme dans une grande variété de domaines d'activité. Cryolite naturelle (Na3AlF6) est utilisé pour préparer Al. Brome et l'iode en tant que substances simples couramment utilisés entreprises pharmaceutiques et chimiques. Dans la production de pièces de rechange pour les voitures, les halogènes sont souvent utilisés. Les phares sont l'un de ces détails. choisir Qualitativement le matériel pour cette partie de la machine est très important, car les phares éclairent la route la nuit, et une méthode de détection à la fois vous et les autres automobilistes. L'un des meilleurs matériaux composites pour la création de phares est le xénon. L'halogène est néanmoins de qualité inférieure à ce gaz inerte.

Un bon halogène est le fluor, un additif largement utilisé dans la production de dentifrices. Il aide à prévenir l'apparition d'une maladie dentaire - les caries.
Un tel élément-halogène, comme le chlore (Cl), trouveSon utilisation dans la production de HCl est souvent utilisée pour la synthèse de substances organiques telles que le plastique, le caoutchouc, les fibres synthétiques, les colorants et les solvants. Les composés chlorés sont utilisés comme agents de blanchiment pour le lin et le coton. bactéries dans l'eau potable.

Attention s'il vous plait! Toxique!
Compte tenu de la très forte réactivitéla capacité des halogènes est appelée à juste titre poison. Le plus clairement, la capacité à rejoindre la réaction est exprimée en fluor. Les halogènes ont des propriétés asphyxiantes prononcées et sont capables d'affecter les tissus pendant l'interaction.
Le fluor dans les vapeurs et les aérosols est considéré comme l'un des plusformes potentiellement dangereuses d'halogènes, nocives pour les êtres vivants environnants. Ceci est dû au fait qu'il est mal perçu par l'odorat et qu'il n'est ressenti qu'après avoir atteint une concentration élevée.
Résumer
Comme nous le voyons, les halogènes sont très importantspartie du tableau périodique de Mendeleyev, ils ont de nombreuses propriétés, se distinguent par leurs qualités physiques et chimiques, la structure atomique, le degré d'oxydation et la capacité à réagir avec les métaux et les non-métaux. Dans l'industrie, ils sont utilisés de diverses façons, depuis les additifs jusqu'aux produits de soins personnels en passant par la synthèse de produits chimiques organiques ou d'agents de blanchiment. Malgré le fait que l'un des meilleurs moyens de maintenir et de créer de la lumière dans le phare d'une voiture est le xénon, l'halogène n'en est pas moins inférieur et largement utilisé et a ses avantages.
Maintenant vous savez ce qu'est l'halogène. Skanvord avec toutes les questions sur ces substances pour vous n'est plus un obstacle.






